В последнее время, причем не без основания, запоры возводятся в ранг самостоятельного заболевания; и все же они чаще всего являются симптомом другой патологии, скажем, гастрита, холецистита, спастического или атонического колита и др.
Определение хронического запора
Следует различать понятия "хронический запор" и так называемый "эпизодический" или "ситуационный" запор. Эпизодические запоры в большинстве своем возникают в течение определенного, непродолжительного периода времени и обуславливаются различными вызывающими их причинами и ситуациями (при наличии у человека исходной склонности и предрасположенности к запорам).
К данным запорам относятся: запоры у туристов; запоры при беременности; запоры, вызываемые употреблением определенных продуктов (чай, какао, продукты с низким содержанием балластных веществ, сниженное содержание в рационе жидкости и т.д.); запоры, обусловленные различными эмоциональными факторами (психические перегрузки, депрессия); запоры, как побочный эффект, вызванный приемом лекарств. Такие запоры, как правило, заболеванием не считаются. Далее в данном разделе главным образом речь идет о хроническом запоре.
Определение хронического запора
Для большинства людей хроническую задержку опорожнения кишечника более чем на 48 часов следует рассматривать как запор. Для него характерны малое количество кала, его повышенная твердость и сухость, отсутствие чувства полного опорожнения кишечника после дефекации. У больных, страдающих запором, встречаются все эти признаки, однако некоторые из них могут и отсутствовать. Наличие даже одного из перечисленных симптомов свидетельствует о запоре. Изменение привычных для данного человека частоты и ритма дефекаций - также важный признак запора.
Очень интересны по емкости и правильности определения запора, которые давали этому синдрому медики прошлых веков: "задержание того, что должно быть извергнуто", "слабость изгоняющей и мощность удерживающей силы", "узость проходов и закупорка их", "плотность и вязкость вещества", "утрата ощущения необходимости изгнать, ибо опорожнению способствует и сила воли". Действительно, задержка продвижения содержимого толстой кишки в определенных сегментах, слабость мышц стенок самой кишки и мощное сопротивление спазмированного заднепроходного сфинктера, органические или функциональные сужения просвета ободочной кишки, уплотненные каловые комки, утрата волевого позыва на дефекацию - все эти звенья патогенеза запоров и сейчас представляются наиболее важными.
Состояние «затруднения продвижения каловых масс в прямой кишке и невозможность их изгнать, несмотря на натуживания» хорошо известно - больным приходится надавливать пальцами на промежность, на боковые стенки заднего прохода, на влагалище. Это систематическое состояние неполного опорожнения прямой кишки вызывает в некоторых случаях впоследствии заболевание - синдром опущения промежности.
В медицинской литературе приводится много определений хронического запора, но в основном все они сводятся к следующему:
Диагноз хронический запор может быть поставлен, если:
- частота стула становится реже, чем 3 раза в неделю;
- дефекация требует напряжения;
- стул плотный или бугорчатый;
- возникает ощущение неполного опорожнения кишечника.
В связи с высокой распространенностью сегодня запор относят к социально значимым проблемам. Хронические запоры относятся к частым расстройствам здоровья и, по данным медицинской статистики, встречаются особенно часто у маленьких детей и пожилых людей в возрасте старше 60 лет. Запоры настолько часты и настолько отягощают состояние миллионов людей во всем мире, что этот сложный синдром ныне часто рассматривается отдельно и, так же, к примеру, как боль, становится предметом самостоятельного изучения проктологов, гастроэнтерологов, психоневрологов и врачей других специальностей.
Причины возникновения хронического запора
Причины запоров многочисленны. Их трудно рассматривать отдельно от форм этого синдрома. Все же можно представить несколько важнейших факторов, ведущих к замедлению каловых масс по толстой кишке.
Запор вызывается нарушением процессов формирования и продвижения кала по кишечнику. Основными причинами этого являются расстройства двигательной деятельности (моторики) мышц кишечника, ослабление позывов к дефекации, изменения строения кишечника или ближайших к нему органов, препятствующие нормальному продвижению содержимого, несоответствие между вместимостью толстой кишки и объемом кишечного содержимого.
Разберем более подробно все эти ситуации.
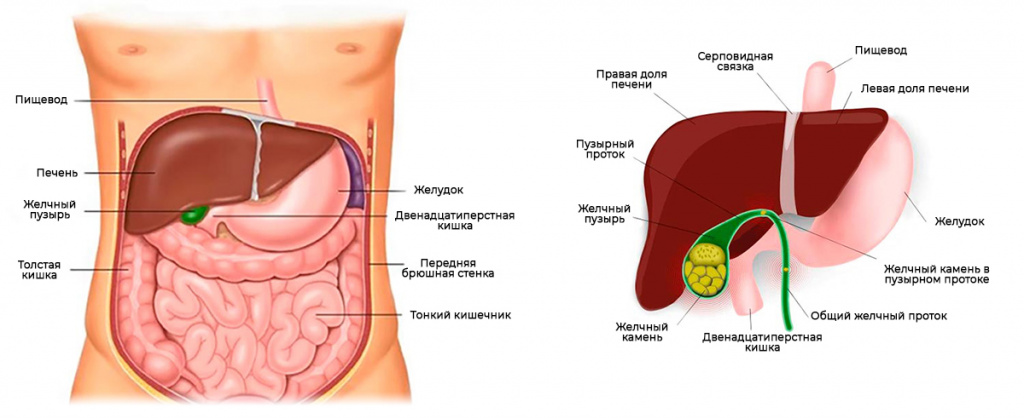
Как известно, кишечник состоит из двух отделов - тонкой и толстой кишки. Толстую кишку в зависимости от функции разделяют на 3 отдела: проксимальный (начальный) отдел; дистальный отдел, расположенный ближе к заднему проходу; прямая кишка.
В норме ежедневно в проксимальный отдел толстой кишки поступает в среднем 1-2 литра жидкого содержимого, в этом отделе происходит его перемешивание, что создает условия для оптимального контакта содержимого с поверхностью слизистой оболочки кишки и способствует всасыванию воды и различных солей. Дистальный отдел выполняет функцию резервуара, обеспечивающего накопление, формирование и удаление каловых масс. Прямая кишка играет существенную роль в процессе дефекации.
В кишечнике периодически возникают электрические импульсы, приводящие к сокращениям гладкой мускулатуры кишки. Перистальтические сокращения способствуют перемещению содержимого по кишке, его перемешиванию и сгущению. Позывы на дефекацию возникают тогда, когда кал, попадая в прямую кишку, растягивает ее и раздражает рецепторы (нервные окончания) в слизистой оболочке. С возрастом чувствительность рецепторов прямой кишки понижается и требуется большее давление, чтобы вызвать позыв на дефекацию.
Дефекация представляет собой частично произвольный и частично непроизвольный акт. Обычно, когда человек по утрам принимает вертикальное положение, скопившийся за ночь кал начинает давить на нижние, наиболее чувствительные части ампулы (расширенной части) прямой кишки, что вызывает позыв на дефекацию. Это наиболее физиологичный ритм опорожнения кишечника.
Нарушения двигательной функции кишечника, способствующие возникновению запоров, могут быть вызваны многими причинами. Прежде всего, это разнообразные неврогенные факторы. К ним относится так называемая вегетативная дисфункция, представляющая собой расстройство деятельности вегетативного отдела нервной системы, регулирующего функции внутренних органов. Это происходит под влиянием психического перенапряжения, конфликтных ситуаций, депрессии, страхов, при длительных нарушениях режима дня, отдыха и др. К факторам, вызывающим запор с участием нервных механизмов, относятся также рефлекторные воздействия на кишечник со стороны различных органов, прежде всего, желудка и желчных путей.
При заболеваниях желез внутренней секреции (щитовидной железы, надпочечников и др.) в связи с усилением или ослаблением гормонального влияния на движения кишечника могут возникать запоры.
Расстройства кровообращения в сосудах кишечника при атеросклерозе и других сосудистых заболеваниях сказываются на перистальтике кишечника и вызывают запоры.
Недостаточная физическая активность (гиподинамия) способствует торможению двигательной функции кишечника и появлению запоров, в большей степени у пожилых и старых людей.
Отдельно следует остановиться на лекарствах, которые способны вызывать запоры, особенно при длительном их употреблении. В наибольшей степени это присуще атропину, различным наркотическим средствам, некоторым противосудорожным препаратам (Дифенин), кальция гидрокарбонату (питьевая сода). Могут вызвать запоры психотропные препараты (транквилизаторы, антидепрессанты), некоторые мочегонные, препараты железа, алюминия гидроксид (Алмагель).
Нарушениям ритма дефекации способствуют позднее вставание, утренняя спешка, работа в различные смены, изменения привычных условий жизни и труда.
Подавляют позывы антисанитарные условия в туалетах, иногда чувство ложного стыда и др.
Причиной запоров часто являются воспалительные заболевания кишечника.
Создают препятствие для продвижения кала по толстой кишке опухоли, сужения кишки в связи с образованием в ней рубцов и другие патологии.
Явные причины запоров:
Обеднение пищи грубой клетчаткой параллельно со снижением потребления жидкости и со снижением физической активности. Это характерно для жителей развитых стран, в которых пища, как правило, рафинированная, а ее потребители мало активны физически. Некоторые исследователи относят сюда же такой феномен как частое сдерживание дефекаций;
Неврологические расстройства - инсульт, болезнь Паркинсона, болезнь Гиршпрунга, повреждения и опухоли спинного мозга, рассеянный склероз и астеноневротическое состояние;
Эндокринные поражения - гипотиреоз, предменструальный синдром, беременность, сахарный диабет, гипокальцинемия;
Болезни желудочно-кишечного тракта - язвенная болезнь, хронический панкреатит, дисбактериоз, синдром раздраженной толстой кишки и, конечно, опухоли толстой кишки.
Нарушение функции мышц тазового дна - ректоцеле, выпадение прямой кишки, нарушение физиологического акта дефекации.
Имеется два основных механизма развития хронических запоров - дискинезия толстой кишки и нарушение акта дефекации (дисхезия). В первом случае дело в расстройстве координации кишечных сокращений или в нарушении тонуса кишечной стенки вследствие расстройства нервной регуляции толстой кишки и воздействии гормонов. Второй механизм - психогенное подавление акта дефекации, гипертонус анального сфинктера, снижение чувствительности рецепторов прямой кишки и мышц тазового дна.
Выявить главную причину запора можно, казалось бы, уже по тщательно собранному анамнезу (образ жизни, привычная диета, предыдущие заболевания и пр.), но это только вершина айсберга, только отправной пункт для целенаправленного обследования.
Наиболее частые причины хронических запоров
1. Образ жизни и привычки
Неподходящее время или условия для дефекации. Игнорирование ощущения полноты прямой кишки, угнетающее рефлекс дефекации (Сопутствующие симптомы и способствующие обстоятельства: постельный режим, перегруженный рабочий день, незнакомая обстановка)
Необоснованное ожидание стула. Ожидание более «регулярного» или более частого стула, чем тот, который являлся для больного нормальным (частое применение рекламируемых слабительных средств)
Диета, бедная растительными волокнами. Уменьшение количества каловых масс (истощение организма, прием препаратов, способствующих запору)
2. Синдром раздраженной толстой кишки
Частое нарушение двигательной функции кишечника (скудный, жесткий стул, часто со слизью, чередующийся с поносами; схваткообразные боли в животе; стресс может углубить нарушение функции кишечника)
3. Механическая непроходимость
Рак прямой или сигмовидной кишки. Прогрессирующее сужение просвета кишки (изменение ритма и регулярности стула, поносы, боли в животе, кровотечение; при раке прямой кишки тенезмы, карандашеподобное изменение калового столбика)
Копростаз. Неподвижные скопления затвердевших каловых масс в прямой, реже в толстой кишке (ощущение переполнения в прямой кишке, боли в животе, понос - жидкие фекальные массы обтекают «каловую пробку»)
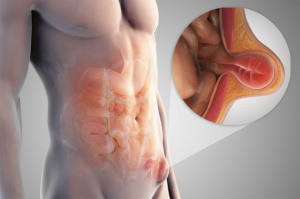
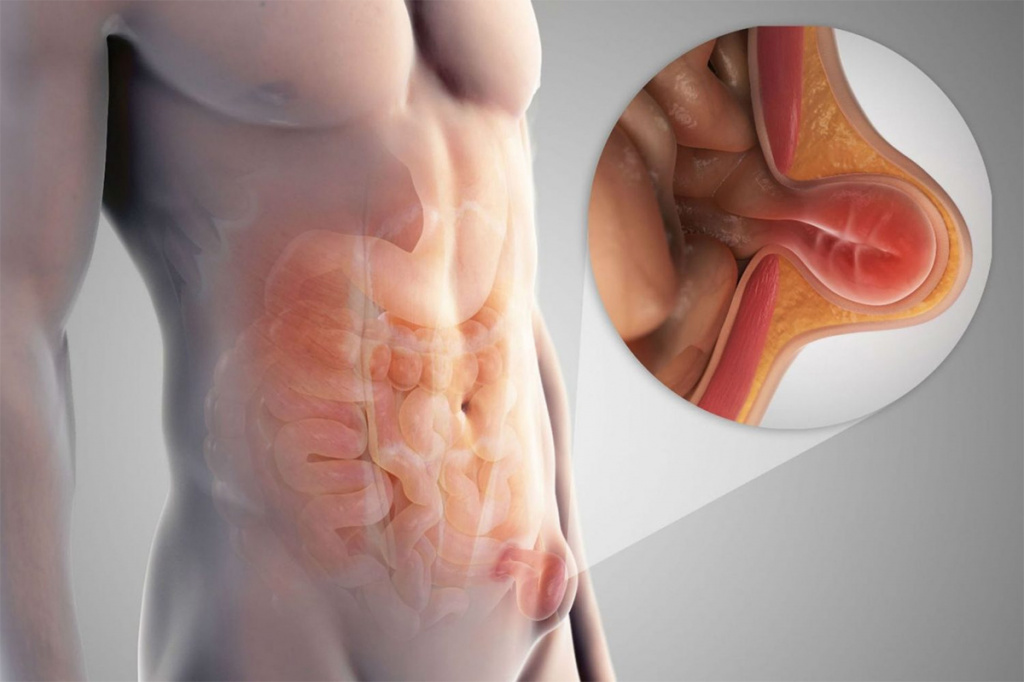
Другие обтурирующие заболевания - дивертикулит, заворот кишок, инвагинация, ущемление грыжи. Сужение или полное закрытие просвета кишки (коликообразные боли в животе, вздутие живота, стул в виде «малинового желе» при инвагинации из-за наличия крови и слизи)
4. Заболевания анального канала, сопровождающиеся болью
Боль может вызвать спазм наружного сфинктера и подавить рефлекс дефекации (анальные трещины, тромбоз геморроидальных узлов, парапроктит)
5. Прием препаратов
6. Депрессия
Типичный приступ депрессии, характеризующийся минимум пятью из девяти следующих симптомов, на протяжении не менее 2 недель: угнетенное настроение почти каждый день (у детей может проявляться раздражительностью); значительное снижение интереса и безразличие к окружающему; немотивированное увеличение или уменьшение массы тела при повышенном или плохом аппетите; бессонница или сонливость почти каждый день; психомоторное возбуждение или заторможенность почти каждый день; усталость и упадок сил почти каждый день; чувство никчемности существования и греховности; замедление мыслительных процессов, нерешительность, невозможность сосредоточиться; неоднократное появление мыслей о самоубийстве (угнетенное состояние, усталость и другие симптомы)
7. Неврологические расстройства
Нарушение автономной иннервации кишечника (Повреждение спинного мозга, рассеянный склероз, болезнь Гиршпрунга)
Основные этиологические факторы запора:
- алиментарный запор, связанный с недостаточным потреблением пищевых продуктов или жидкости, с качественно неполноценным питанием (дефицит солей кальция, витаминов, растительной клетчатки, а также неправильный ритм питания);
- неврогенный запор - проявление патологических висцеро-висцеральных рефлексов при язвенной болезни, дуодените, хроническом холецистите, почечно-каменной болезни, а также запоры при неврологических заболеваниях - рассеянном склерозе, нарушениях мозгового кровообращения, опухолях и травмах головного и спинного мозга;
- психогенные запоры, прежде всего т.н. привычные, вследствие нарушения привычки ежедневного опорожнения кишечника при перемене места жительства, длительных поездках, длительном вынужденном постельном режиме. Сюда же отнесены запоры при психических заболеваниях;
- запоры, обусловленные аноректальными поражениями - геморроем, анальной трещиной, парапроктитом, сопровождающиеся выраженным спазмом анального сфинктера и т.п.;
- токсический запор: свинцовые, ртутные хронические интоксикации, воздействие некоторых медикаментов - анестетики, нейролептики и др.;
- проктогенные запоры - вызванные нарушением акта дефекации, связанным с нарушением функции мышц тазового дна;
- запоры, обусловленные механическими препятствиями - опухоли, большие полипы и стриктуры толстой кишки, а также аномалии ее развития.
Симптомы и классификация хронического запора
Симптомы при запорах весьма разнообразны и в значительной степени зависят от характера заболевания, ставшего их причиной. В одних случаях запор - единственная жалоба, в других - больные обращают внимание и на другие недомогания.
Частота дефекаций может быть различной: от одного раза в 2-3 дня до одного раза в неделю и реже. Кал обычно уплотнен, сухой, имеет вид сухих темных шариков или комков, напоминает овечий; иногда кал может быть бобовидным, лентовидным, шнурообразным.
У некоторых больных наблюдается так называемый запорный понос, когда при длительной задержке опорожнения кишечника происходит разжижение кала слизью, образующейся вследствие раздражения стенки кишки.
Иногда больных беспокоят боли и чувство распирания в животе; облегчение наступает после дефекации или отхождения газов.
Довольно тягостным симптомом может стать вздутие живота (метеоризм), которое обусловлено медленным продвижением кала по толстой кишке и повышенным образованием газа в результате деятельности бактерий в кишечнике. Вздутие живота, помимо собственно кишечных симптомов, может сопровождаться рефлекторными реакциями других органов: болями в сердце, сердцебиением и др.
У больных при запорах может снижаться аппетит, появляются отрыжка воздухом, дурной вкус во рту. Нередко снижается трудоспособность, возникают головные боли, боли в мышцах тела, общая нервозность, подавленное настроение, расстраивается сон.
Упорные запоры могут сопровождаться изменениями кожи. Она становится бледной, часто с желтоватым оттенком, дряблой, теряет эластичность.
При энтерите (воспалении тонкой кишки) запоры отмечаются у каждого пятого, а при хроническом колите (воспалении толстой кишки) - у каждого второго больного.
Классификация хронических запоров
Запоры без аномалий; заднего прохода, прямой и ободочной кишки и без психических расстройств. Сюда относятся больные с неправильной диетой и образом жизни, запоры у беременных, у людей пожилого и старческого возраста, идиопатические запоры с медленным кишечным транзитом, а, также синдром раздраженного кишечника.
Запоры с нарушениями структур заднего прохода и толстой (прямой и ободочной) кишки. В эту группу включают больных анальной невралгией (в основном, после неудачных операций на заднем проходе или после травм), стенозы ануса различной этиологии, стриктуры толстой кишки, псевдообструкция толстой кишки, и др.
Вторичные запоры, вызванные внекишечными аномалиями и заболеваниями. К этой группе относят эндокринные поражения (гипотиреоз), неврологические расстройства (повреждения спинного мозга, крестца, боли при напряжении из-за сдавления ветвей седалищного нерва), системный склероз и другие заболевания соединительной ткани.
Психологические причины запоров. Это депрессия, нейрогенная анорексия.
Запоры, связанные с побочным действием лекарств.
Осложнения хронического запора
Длительно существующий запор может вызывать различные осложнения: вторичный колит, проктосигмоидит (воспаление сигмовидной и прямой кишки).
При длительном застое содержимого в слепой кишке возможно обратное его забрасывание в тонкую кишку с развитием энтерита (рефлюкс-энтерит). Запоры могут осложняться заболеваниями желчевыводящих путей, гепатитом.
Длительные запоры способствуют появлению различных болезней прямой кишки. Чаще всего возникает геморрой, а также трещины прямой кишки, воспаление околопрямокишечной клетчатки (парапроктит).
Иногда они становятся причиной расширения и удлинения толстой кишки (приобретенный мегаколон), что делает запоры еще более упорными.
Наиболее грозным осложнением длительных запоров является рак прямой и толстой кишки. Существует мнение, что застой содержимого в кишечнике, вызванный употреблением продуктов, бедных пищевыми волокнами, приводит к большой концентрации образующихся в кишечнике канцерогенных (способствующих развитию рака) веществ и длительному их действию на стенку кишки. Тревожными симптомами, позволяющими заподозрить возможность возникновения опухоли толстой кишки, являются общее плохое самочувствие, похудание, недавнее появление запора у людей старше 50 лет, стул у которых до того был нормальный, кровь в кале.
Каловый завал
Наконец, о таком очень неприятном явлении как каловый завал. Это состояние довольно часто имеет место у стариков и у психических больных. Такое осложнение запора возникает, когда пожилые люди, особенно плохо ухоженные, забывают время последней дефекации и перестают следить за ее регулярностью. Дело осложняется тем, что вокруг образующегося и постепенно уплотняющегося в прямой кишке калового камня долго остаются щели между ним и стенками кишки, по которым жидкий кал проходит; больному представляется, что у него понос, и он начинает его лечить домашними средствами, что, понятно, только усугубляет процесс. Наступает частичная непроходимость прямой кишки, появляются боли в животе, пропадает аппетит, появляется отрыжка, тошнота, рвота. При обследовании таких больных пальцем обычно достигается нижний полюс калового комка каменистой плотности. Обычно при этом у пожилого больного имеется сопутствующая сердечная или легочная недостаточность или другие серьезные расстройства здоровья, так что лечение калового завала - дело трудное. Прежде всего - никаких слабительных; их надо употреблять раньше, а при описываемом состоянии они могут привести только к нарастанию кишечной непроходимости. Клизмы также не помогут: клизменный наконечник обычно не может свободно проникнуть выше камня, им нельзя вслепую пользоваться с целью дробления камня из-за опасности травмы стенки кишки. Необходимо рукой а толстой резиновой перчатке, хорошо смазав указательный палец мазью, начинать осторожное и постепенное дробление дистальной части камня, извлекая его освободившиеся обломки. Положение больного на боку (лучше на левом, если нет выраженных сердечных расстройств) с согнутыми в коленях и прижатыми к животу ногами. Обычно эта манипуляция удается без особого труда ибо, как правило, у таких больных тонус заднепроходного сфинктера снижем и анус почти зияет. Тем не менее, процедура эта длительная и, мягко говоря, дискомфортная для больного, поэтому в таких случаях предварительно назначаются седативные или болеутоляющие препараты. Когда наиболее плотные дистальные участки камня раздроблены, остальные, верхние его части удаляются намного легче и в конце либо начинается самостоятельная, очень обильная дефекация, либо следует выполнить сифонную клизму. Разрешив каловый завал, больному или его родственникам объясняют меры профилактики задержки стула (лучше всего еженедельные очистительные клизмы), ибо если ограничиться только извлечением калового камня (камней), то все начнется сначала.
Диагностика хронического запора
Диагностика играет очень важную роль в процессе лечения хронических запоров. Простое назначение слабительных средств пациенту с жалобами на запоры может оказаться не только малоэффективным, но и в некоторых случае сыграть крайне негативную роль.
При жалобах на запоры очень важно правильно назначить необходимые диагностические исследования, и в результате получить полную картину причин заболевания. Только в этом случае врач сможет назначить правильный и эффективный курс лечения.
Разнообразие вариантов и причин запоров порой порождает у врача желание упростить подход к диагностике этого состояния. Однако, нежелание уточнить механизм развития запора нередко приводит к потере времени, закреплению рефлекторных связей, развитию вторичных изменений со стороны кишки и "фиксации ситуации", т.е. переходу ее из функциональной в органическую. Поэтому при первом появлении запора необходимо провести диагностический поиск, этапы которого представлены ниже:
I этап.
Оценка клинических данных и рентгенологическое исследование кишечника, которое позволяет оценить анатомическое состояние толстой кишки: раздражение или нормальное ее строение при функциональных расстройствах, опухоли, аномалии или мегаколон, характерные для обструкции, гипоганглиоза, идиопатического расширения.
II этап. Колоноскопия, гистологическое и гистохимическое исследование биоптатов слизистой оболочки кишки.
III этап.
Специальные методы исследования, позволяющие оценить моторно-эвакуационную функцию толстой кишки, микробный спектр или содержание летучих жирных кислот (интегральный показатель микробного ценоза), состояние запирательного аппарата прямой кишки, функцию других органов и отделов желудочно-кишечного тракта, эндокринного аппарата, вегетативной нервной системы (для женщин обязателен осмотр гинеколога с целью определения положения матки).
Выполненная программа обследования позволяет ответить на основной вопрос - вызван ли запор заболеванием или является функциональным расстройством. Наиболее распространенными остаются функциональные запоры, диагностика которых требует исключения органических заболеваний. Поликлинический этап исследования включает в себя тщательный сбор и анализ анамнестических данных, осмотр, пальпацию брюшной полости, осмотр области ануса и пальцевое исследование прямой кишки, ирригоскопию и колоноскопию. Исследование моторно-эвакуаторной функции производится в стационаре. И только после того, как диагностика осуществлена, определены формы, подлежащие хирургическому лечению, привлечены к лечению эндокринологи, психиатры, гинекологи, проводится длительное (иногда месяцы и годы) лечение запора.
Методы диагностики при хронических запорах могут включать:
- ирригоскопию - рентгенологическое исследование;
- колоноскопию;
- посев кала на микрофлору (дисбактериоз);
- исследование двигательной функции толстой кишки;
- функциональные исследования запирательного аппарата аппарата прямой кишки;
- гистологическое и гистохимическое исследование биоптатов слизистой оболочки;
и др.
Решение о назначение того или иного метода исследования врач принимает на основании жалоб больного, особенностей течения заболевания и других факторов.
Лечение хронического запора
Мнение, что лечение хронического запора является легкой задачей, и для ее решения достаточно приобрести в аптеке "хорошее" слабительное - глубокое заблуждение.
Проблема лечения хронического запора требует обязательной консультации со специалистом.
Длительное, самостоятельное употребление слабительных средств без знания их механизма действия, показаний и противопоказаний, в большинстве случаев дает прямо противоположный результат:
- запоры приобретают более стойкую и тяжелую форму;
- значительно снижается моторика кишечника, его двигательная активность;
- доза слабительного сначала постоянно растет, затем его действие становиться неэффективным;
- возникают проблемы, связанные с нарушением процесса обмена веществ в организме.
Таким образом, проблема лечения хронического запора требует самого серьезного подхода, как со стороны пациента, так и со стороны лечащего врача.
Залог успешного лечения хронического запора - это выявление истинной его причины из существующего целого ряда причин и факторов и ее устранение.
Лечение хронического запора требует индивидуального подхода в каждом конкретном случае, но общие принципы в диагностике и лечении все же существуют и состоят в последовательном выявлении или исключении возможных причин заболевания, и назначении по результатам обследований соответствующего лечения:
1. Первичная консультация врача - разъяснительная беседа с пациентом о проблеме запора, сбор подробного анамнеза, рекомендации общего характера:
- диетические рекомендации;
- отмена или нейтрализация "закрепляющих" препаратов;
- рекомендации по физической активности.
При сборе намнеза особое внимание обращается на длительность запора, частоту стула и характер дефекации - без натуживания, скорость (время) опорожнения, боли в заднем проходе, чувство неполного опорожнения (тяжесть внизу живота), патологические выделения со стулом (особенно кровь). Выясняются сопутствующие заболевания, применяемые лекарства и т.д.
2. Диагностика - выявление возможных причин запора.
Исключение или подтверждение "механических" и органических причин хронического запора, а так же аномалий строения толстого кишечника (методы обследования - колоноскопия, ирригоскопия и др.).
- наличие рака прямой, сигмовидной или толстой кишки;
- наличие крупных полипов толстого кишечника,
- наличие сужений просвета толстой кишки;
- наличие каловых камней, завалов;
- наличие дивертикулеза;
- наличие ректоцеле, мегаколон;
- наличие спаечного процесса в брюшной полости;
- наличие заворота кишок, инвагинации, ущемления грыжи.
Исключение или подтверждение заболеваний желудочно-кишечного тракта и аноректальной области: синдром раздраженной кишки, дисбактериоз, колиты, язва, анальная трещина, острый геморрой, парапроктит и др. (методы обследования - колоноскопия, анализ кала, ректальное пальцевое исследование, аноскопия, ректороманоскопия и др.).
Исключение или подтверждение причин неврологического, психогенного характера (консультация невропатолога, психотерапевта).
Исключение или подтверждение причин эндокринного характера (консультация эндокринолога, лабораторные исследования)
3. Назначение лечения (хирургическое или терапевтическое).
Хирургическое лечение запоров может проводиться только после тщательного всестороннего обследования больных в специализированных проктологических клиниках. Показания к операции и ее объем должны подбираться индивидуально, и следует помнить, что хирургия запоров это жест отчаяния, последнее средство, прибегать к которому следует только в самых крайних случаях.
Рекомендации по лечению функциональных запоров
Здесь речь идет о т.н. функциональных запорах, причины которых различны (но не механические), но не об опухолевых или других органических стриктурах толстой кишки. В последнем случае только своевременная диагностика и этиологическое, чаще всего хирургическое лечение могут дать успех.
Самостоятельная, без врачебного обследования, борьба с запорами во многих случаях задерживает диагностику настоящей причины запора.
Диетический режим
Лечение запоров следует начинать, прежде всего, с регулирование диеты. Необходимо вводить рацион питания постоянно и ежедневно продукты, богатые растительной клетчаткой: овощи, фрукты, грубый черный хлеб (иногда специально пищевые отруби) и не меньше 2 литров жидкости в день. Если употребление в пищу овощей и фруктов сопровождается вздутием живота и метеоризмом, рекомендуется принимать препарат Мукофальк. Питаться необходимо регулярно, в одно и тоже время.
Соблюдение определенных требований к составлению пищевого рациона больного с запором играет огромную роль в его лечении. Каждый человек, страдающий запором, должен знать, какие пищевые вещества способствуют опорожнению кишечника и какие задерживают его опорожнение.
Способствуют опорожнению кишечника черный хлеб, сырые овощи и фрукты, сухофрукты, хлеб, содержащий значительное количество отрубей; крупы: гречневая, ячневая, овсяная; мясо с большим количеством соединительной ткани; соленья, маринады, сельдь; копчености, закусочные консервы; безалкогольные напитки (минеральные воды, лимонад, соки), пиво, квас, сметана, сливки; сладкие блюда, кисели; кисломолочные продукты: простокваша, однодневный кефир, белые виноградные вина.
Задерживают опорожнение кишечника продукты, содержащие танин: сушеная черника, крепкий черный чай, какао, натуральные красные вина (кагор и др.); пища в протертом виде, вещества вязкой консистенции (слизистые супы, протертые каши, особенно манная и рисовая).
При составлении пищевого рациона для больных, страдающих запорами, следует учитывать содержание пищевых волокон в продуктах. При большом количестве употребления в пищу грубых волокон у людей с метеоризмом выделяется в среднем в 2 раза больше газов, чем при диете с умеренным их содержанием, и почти в 5 раз больше, чем при употреблении жидкой химически однородной диеты без пищевых волокон. Больным с запором и жалобами на вздутие живота ограничивают или даже исключают из рациона продукты, богатые пищевыми волокнами. Исключают вызывающие повышенное газообразование блюда из бобов, капусты, щавеля, шпината и др. Из фруктовых соков не рекомендуются яблочный, виноградный.
При запорах, сопровождающихся выраженной перистальтикой кишечника, особенно при наличии спастических болей в животе, диета, богатая пищевыми волокнами, может вызвать усиление болей. В подобных случаях на первых порах применяют диету с низким содержанием пищевых волокон. Для уменьшения и последующей ликвидации спазмов кишечника назначают антиспастические лекарства, затем постепенно добавляют в пищу продукты, содержащие клетчатку нежной, а впоследствии более грубой консистенции. Так как сливы содержат органические кислоты, способствующие опорожнению кишечника, то, несмотря на сравнительно невысокое содержание в них волокон (0,5 г на 100 г), больным с запором рекомендуют чернослив в любом виде, в том числе настой, пюре из сухофруктов.
Если нет специальных противопоказаний (болезни сердца, отеки), то больной, страдающий запорами, должен выпивать в сутки примерно 1,5-2 л жидкости. Прием достаточного количества жидкости очень полезен, так как вследствие замедленной эвакуации каловых масс из кишечника происходит их высыхание, что, в свою очередь, затрудняет их продвижение по толстой кишке.
Важно соблюдать правильный режим питания. Пищу необходимо принимать не реже 5 раз в день. Недопустимы большие перерывы между приемами пищи.
Весьма существенный лечебный эффект при запорах дают отруби. Отруби устойчивы к действию пищеварительных соков, они не являются значимым источником энергии и в то же время значительно стимулируют эвакуаторную функцию кишечника.
Ритмичность опорожнения
Не менее важен ритм опорожнения кишечника. Он индивидуален и не следует отрабатывать искусственную "норму" и настаивать, к примеру, чтобы стул был ежедневным, если обычно дефекация один раз в 2 или даже в 3 дня. Задача не столько в учащении дефекации, сколько в профилактике натуживаний, т.е. в разжижении стула. Ни в коем случае не подавляйте искусственно позывы на дефекацию, это только усугубляет проблему.
Лекарственные и очистительные клизмы
Лекарственные клизмы предназначены главным образом для облегчения процесса опорожнения (масляные клизмы с рыбьим жиром, подсолнечным маслом и др.).
Очистительные клизмы так же используются, как средство лечения запоров. Очищение толстой кишки водяной клизмой (1,5-2 литра кипяченой воды комнатной температуры, без всяких примесей) на ночь, один раз в неделю (лучше в субботу) весьма полезно. Речь идет именно об одной клизме, а не о целой системе высоких и сифонных очистительных клизм.
Отмена "закрепляющих" препаратов
Необходимо по возможности отменить (или заменить другими) препараты, способные вызывать или усиливать запоры. К ним относятся опиаты, антациды, ганглиоблокаторы, диуретики, препараты железа, психотерапевтические средства, а также пероральные противозачаточные препараты. Если вы постоянно принимаете какие-либо лекарственные препараты, прочитайте в прилагаемой к ним аннотации, нет ли среди побочных эффектов запоров.
Повышение физической активности
Большую роль в профилактике и лечении запоров играет соблюдение активного двигательного режима. Недопустимо позднее вставание с постели по утрам, длительное лежание. Весьма полезны пешие или лыжные прогулки, плавание, езда на велосипеде и другие физические нагрузки. Физические упражнения стимулируют двигательную активность кишечника, укрепляют мышцы брюшной стенки, повышают тонус всего организма, благоприятно действуют на нервно-психическую сферу.
Больным с запорами показаны минеральные воды: Ессентуки №4, Баталинская, Славяновская, Джермук и др.
При снижении двигательной деятельности кишечника, о чем свидетельствует большое количество кала, рекомендуют более минерализованную воду - Ессентуки №17. При запорах с повышенной сократительной деятельностью кишечника, при болях в животе предпочтительнее прием теплой минеральной воды.
Повышение физической активности ведет к усилению моторики кишечника и усилению мышц живота и тазового дна, что благоприятно сказывается на процессе опорожнения и соответственно лечении хронического запора.
Применение слабительных средств
К слабительным следует прибегать только в тех случаях, когда перечисленные выше меры не достаточно эффективны. Что касается слабительных, то их можно делить на несколько групп: увеличивающих объем каловых масс (отруби, семена, синтетические средства), раздражающего действия (антрахиноны и производные дифенилметана), повышающие осмотическое давление в кишечнике, усиливающие моторную функцию кишечника (прокинетики), размягчающие фекалии (жидкий парафин).
К выбору и приему слабительного следует подходить с предельной осторожностью. При хроническом запоре не рекомендуется длительный прием слабительных средств раздражающего действия и усиливающих моторику кишечника. Длительный прием этих средств, как правило, приводит к зависимости - к синдрому "ленивого кишечника". Если для нормального опорожнения вам требуется все большая доза слабительного, а без его применения возникает устойчивый запор - бейте тревогу. Нужно поменять препарат, но лучше проконсультироваться по этому поводу с врачом. При нормальном употреблении слабительного, в качестве средства для лечения хронического запора, его доза должна постепенно уменьшаться, вплоть до полного отказа от его употребления.
В относительно легких случаях целесообразней прибегать к более "естественным" слабительным, лучше всего действуют смеси инжира, чернослива и кураги с медом и александрийским листом (препарат Регулакс). Отдельно стоит проблема фитотерапии запоров. Многолетний опыт однозначно свидетельствует в пользу применения различных слабительных сборов трав (геморроидальный чай и др.), но, при одном условии: все травы можно покупать только в аптеках. Фитотерапевтические слабительные так же могут привести к зависимости, так что длительное их применение не желательно.
Правильное питание при запоре
Запоры — один из симптомов, свойственных различным заболеваниям органов пищеварения. Они могут наблюдаться при язвенной болезни желудка и двенадцатиперстной кишки, геморрое, полипах кишечника. Для того чтобы правильно подобрать лечение, в частности диетическое питание, необходимо точно знать причину заболевания. Вот почему при длительных запорах необходимо обратиться к врачу и пройти назначенное им обследование. Советы по лечебному питанию при этом имеют много индивидуальных особенностей. Поэтому при появлении склонности к запорам ни в коем случае не надо заниматься самолечением. Врач назначит лечение с учетом основного и сопутствующих заболеваний.
Распространенность запоров в последнее десятилетие связана с гиподинамией, систематическим несоблюдением режима питания, использованием в пищу продуктов, содержащих мало пищевых волокон (растительной клетчатки), которые способствуют перистальтике кишечника. Увлечение пищей, содержащей животные белки (мясом, рыбой, яйцами, творогом), также может предрасполагать к запорам. Аналогично длительное соблюдение чрезмерно щадящих диет может приводить к нарушению эвакуаторной функции кишечника.
Прибегать к слабительным средствам и очистительным клизмам при запорах разрешается только по рекомендации лечащего врача. Диетическая корректировка рациона питания с учетом сказанного выше часто оказывается самым эффективным средством лечения запоров и их профилактики.
Пищевая клетчатка
Пищевая клетчатка (пищевые волокна, грубоволокнистая клетчатка) это часть растений, в основном, злаковых, потребляемая нами в пищу и составляющая наряду с жирами, белками, углеводами, витаминами необходимый питательный баланс. Пищевые волокна не перевариваются в пищеварительном тракте, а утилизируются микрофлорой кишечника. Основная функция клетчатки — адсорбция воды, но параллельно она играет важную роль в других процессах - снижает уровень холестерина в крови путем связывания кишечных желчных кислот, имеющих, как известно, определенную канцерогенную активность. Адсорбция воды в кишечнике увеличивает объем каловых масс и снижает риск запоров. По своему химическому составу пищевая клетчатка это неусваиваемая целлюлоза. По содержанию ее в продуктах на первом месте пищевые отруби (53-55% волокон), затем овощи (20-24%) и ржаной хлеб. Рафинированные продукты - белая мука, сахар и др. - пищевой клетчатки не содержат. В регионах, где потребление клетчатки снижено, риск поражений толстой кишки и, прежде всего запоров, выше. У некоторых групп африканцев-аборигенов, почти не употребляющих в пищу мясо и молоко, стул обычно полужидкий; у них на порядок меньше частота полипов и рака толстой кишки, чем у жителей развитых стран, употребляющих рафинированные продукты.
Существует мнение о возможности наличия связи хронических запоров и развития рака толстой кишки. В частности, известно, что в некоторых странах и регионах частота рака толстой кишки резко колеблется, причем разница может быть 20-ти кратной, и эта разница прямо коррелирует с особенностями пищевого рациона в этих регионах. Ни в коем случае не отрицая роли предраковых поражений толстой кишки (аденомы) и возможного содержания в пище таких признанных канцерогенов как нитриты и нитраты, заметим, что "западный" тип питания с превалирующим употреблением рафинированных продуктов характерен для населения более развитых стран, в которых рак толстой кишки и - отметим специально - запоры достоверно более часты. При высоких доходах употребление в пищу больших количеств животных белков, жиров и относительно малого количества углеводов ведет к увеличению времени кишечного транзита и к снижению концентрации бактериальных метаболитов толстой кишки. При таком типе питания основные метаболические процессы идут не в толстой, а в тонкой кишке и, стало быть, в толстую кишку попадает содержимое, намного более насыщенное бактериальной, возможно канцерогенной, флорой, что наглядно прослеживается при анализе фекалий людей из разных по типу питания популяционных групп. Все это дает теоретические основания для выдвижения или хотя бы обсуждения возможной связи нарушений, т.е. замедлений транзита по толстой кишке, и предраковых поражений или рака толстой кишки.
Увеличивая массу кала, пищевые волокна снижают риск запоров. При этом обязательное условие - увеличенное потребление воды (1,5-2 литра в сутки), без чего пищевая целлюлоза (пектин, другие синтезированные ее препараты) перестает выполнять адсорбирующую функцию. Так что отруби - важный диетический компонент комплексного лечения запоров.
Механизм действия балластных веществ на транспорт кишечного содержимого.
Балластные вещества ускоряют пассаж содержимого по кишечнику благодаря увеличению массы кала.
Многочисленные исследования показали, что эти взаимоотношения прослеживаются как у здоровых, так и у больных, страдающих запорами. Увеличение массы кала достигается здесь в основном за счет 2-х различных механизмов. Один из них включает в себя связывание воды, что обуславливается физико-химическими свойствами данных веществ. При этом различная способность связывать воду зависит здесь от вида балластных веществ (гемицеллюлоза, целлюлоза и лигнин). Они впитывают воду в результате заполнения пустых пространств волокнистой структуры веществ, в то время как у неструктурированных балластных веществ (пектин, семена подорожника) связывание воды происходит с помощью гидроколлоидов в гели и вискозные растворы. Кроме того балластные вещества увеличивают бактериальную массу кала и тем самым повышают собственную ферментативную активность бактерий. Продукты бактериального расщепления, особенно короткоцепочные жирные кислоты (масляная кислота, пропионовая кислота и др.), способствуют нормальной жизнедеятельности клеток слизистой оболочки толстой кишки и регулируют моторику кишечника. Освобождающиеся газы усиливают растяжение толстой кишки, что, с одной стороны, стимулирует пропульсивную моторику кишечника, а ,с другой стороны, может приводить к появлению метеоризма.
Потребность в балластных веществах.
В конце прошлого столетия люди ежедневно употребляли в пищу примерно 100 г балластных веществ в день. В настоящее время это потребление снизилось в среднем до 15-20 г в день, причем более молодые люди употребляют заметно больше балластных веществ, чем пожилые. Немецкое общество питания рекомендует ежедневный прием, как минимум 30 г балластных веществ в день. Это свидетельствует, что средний дефицит данных компонентов пищи составляет 10-15 г в день.
Принимаемые с пищей балластные вещества оказывают, в зависимости от их способности связывать воду, различное действие на качество стула. Так, связывающая способность картофеля и гороха сравнительно невелика и составляет 40-100 г воды на 100 г пищевого продукта, в то время как связывающая способность яблок и моркови составляет соответственно 180 и 220 г воды на 100 г продукта. Отруби и специальные препараты, а также пектины имеют связывающую способность 300-400 г воды на 100 г вещества. Наряду с механизмом увеличения бактериальной массы это ведет к различным количествам этих продуктов, требуемым для удвоения массы кала.
Указанное количество составляет: для хлеба из муки грубого помола, капусты и яблок 400-1400 г продукта в день, для специальных препаратов, таких как отруби, Plantago ovata (Мукофальк) или хьюаровая смола - 30-40 г продукта в день.
Обеспечить достаточное количество балластных веществ мог бы пищевой рацион, включающий в себя 200 г хлеба из муки грубого помола (16 г балластных веществ), 200 г картофеля (7 г), 250 г овощей (7 г) и 250 г фруктов (5 г) в день, что дало бы общее содержание балластных веществ 35 г в сутки.
Переносимость продуктов питания с большим содержанием балластных веществ.
Возможности повышения содержания балластных веществ в пище часто ограничиваются их индивидуальной различной переносимостью больными. В первую очередь, из-за повышенного газообразования и усиления метеоризма плохо переносятся капуста и бобовые. Однако продукты из муки грубого помола, овса, некоторые сорта овощей также могут вызвать появление этих жалоб. Согласно исследованиям пищевые продукты, богатые балластными веществами, переносятся больными с хроническими запорами плохо. Так, овсяная каша или овсяные хлопья с молоком, а также овощи вызывали у 12-45% больных усиление диспепсических жалоб, особенно болей в животе и метеоризма. В свою очередь, кукурузные хлопья не сопровождались появлением указанных расстройств. Отруби, обычно рекомендуемые в таких случаях, вызывали у 55% обследованных пациентов усиление диспептических расстройств. Напротив, специальные препараты, такие как Plantago ovata (Мукофальк), переносились сравнительно хорошо и способствовали у 40% больных уменьшению болей в животе и диспептических расстройств. Это совпадает с результатами исследований, которые показали, что применение препаратов Plantago ovata (Мукофалька) уменьшало выраженность диспептических расстройств и улучшало консистенцию кала в большей степени, чем применение отрубей, которое во многих случаях сопровождалось усилением метеоризма и болей в животе.
Заключение
У больных с редко возникающими запорами для нормализации стула часто оказывается достаточным обогащение пищевого рациона балластными веществами. Больным с хроническими запорами порой приходится рекомендовать такое количество балластных веществ, которое нередко ведет к усилению диспептических расстройств (метеоризма и болей в животе). Таким образом, при назначении больным с хроническими запорами диеты, обогащенной балластными веществами, приходится учитывать ее индивидуальную переносимость. В этой связи во многих случаях оказывается целесообразным дополнительное применение специальных препаратов, содержащих балластные вещества, причем препараты отрубей часто вызывают сильное газообразование и переносятся хуже, чем современные препараты Plantago ovata (Мукофальк). При лечении больных, особенно лиц пожилого возраста, часто имеющих дефицит жидкости, необходимо обращать внимание на ее достаточное потребление. Учитывая возможность связывания балластных веществ с кальцием, железом и цинком с возникновением последующих нарушений минерального обмена, следует избегать их передозировки.
Профилактика запоров
Важное значение имеют меры, направленные на предупреждение перехода острых запоров в хронические.
Острые запоры нередко появляются при острых инфекционных заболеваниях. Их возникновению способствуют щадящая диета, при которой рацион содержит малое количество пищевых волокон, постельный режим, а также воздействие токсичных веществ, вырабатываемых возбудителями инфекционных заболеваний, на кишечник. Предупредить запор при острых инфекциях можно приемом достаточного количества жидкости, включением в рацион протертых овощей, фруктов, компотов, фруктовых соков, кисломолочных продуктов.
Острые запоры часто появляются у больных с тяжелыми заболеваниями сердечно-сосудистой системы, соблюдающих длительный постельный режим. Сокращение сроков постельного режима не противоречит современным представлениям о лечении этих заболеваний и снижает риск возникновения запоров и перехода их в хронические.
Запоры, связанные с потерей позывов на дефекацию, иногда появляются еще в детстве. Воспитание детей, приучающее их к дефекации в определенное время, лучше по утрам, имеет большое значение для предупреждения привычных запоров, обусловленных утратой естественного рефлекса на дефекацию. Привычка пользоваться туалетом в одно и то же время и у взрослых предупреждает появление запоров подобного типа.
Длительные перерывы в приеме пищи могут вызывать нарушения в регулярном ритме эвакуации кишечного содержимого. Сокращение интервалов между отдельными трапезами наряду с обогащением рациона пищевыми волокнами является действенным способом профилактики запоров.
Достаточная физическая активность, утренняя зарядка, прогулки, занятия физической культурой, водные процедуры являются важными факторами в профилактике запоров, особенно у работников умственного труда.
Своевременное лечение различных заболеваний, способствующих возникновению запоров, - важнейшее мероприятие по их предупреждению. Прежде всего, это относится к заболеваниям прямой кишки.
Слабительные средства
Слабительные средства относятся к лекарственным препаратам, которые действительно больные люди или мнимые пациенты принимают в большом количестве. Их широко покупают и принимают даже без врачебного назначения. При этом иногда пациенты в разговоре с врачом, который лечит их по поводу заболеваний, вводят его в заблуждение, сознательно отрицая прием слабительных препаратов или злоупотребление ими, если врач спрашивает их об этом.
Бесспорным представлением тот факт, что употребление слабительных препаратов в последние годы значительно возросло. Причин здесь несколько, основные из них::
- профессии, связанные с недостаточной двигательной активностью;
- недостаточная двигательная активность при проведении свободного времени;
- недостаточное содержание балластных веществ в пищевом рационе;
- возросшее потребление лекарственных препаратов, вызывающих нарушение функций пищеварительного тракта.
Группы слабительных средств
Слабительные препараты не являются единой группой лекарственных средств. В соответствии с механизмом действия их можно разделить следующим образом:
1. Увеличивающие объем кишечного содержимого - растительные волокна (пищевая клетчатка), полисахариды и производные целлюлозы. К этой группе относятся отруби, морская капуста (и препарат из нее - ламинарид), льняное семя, семя подорожника, агар-агар, препараты метилцеллюлозы. Семя подорожника, являющееся источником пищевых волокон, стало основой создания препарата - Мукофальк (10-15 мг/сут). Эти препараты известны как наполнители, они абсорбируют воду и формируют каловые массы, что вызывает их нормальное продвижение с сокращением мускулатуры кишечника, способствует облегчению дефекации. Эти средства совершенно безопасны и могут применяться годами.
2. Размягчающие фекалии - минеральные масла, вазелиновое масло. Они также безвредны, но их длительное применение не рекомендуется. Назначают по 15-45 г на ночь. Вазелиновое масло действует на всем протяжении кишечника. Данные средства применяют в случаях, когда нужно достичь быстрого эффекта, например, при отравлениях, а так же у больных в послеоперационном периоде и при острых болевых анальных синдромах (анальная трещина, ущемление и тромбоз геморроидальных узлов).
3. Повышающие осмотическое давление кишечного содержимого (невсасывающие соли, многоатомные спирты). К этой группе препаратов относятся: лактулоза, сорбитол, свечи с глицерином, голител. Эти препараты не всасываются в кишечнике, связывают воду, повышают количество жидкости в каловых массах, что придает им мягкую кашицеобразную консистенцию. Данные препараты усиливают перистальтику, способствуя очищению кишечника при сохранении электролитного баланса, используются курсами в течение максимум 2 недель или одноразово для подготовки толстой кишки к операции.
4. Раздражающего действия или стимулирующие функцию кишечника, его моторику и пропульсивную сократительную способность. К ним относят фенолфталеин, бисакодил, касторовое масло, солевые слабительные (раствор магнезии),различные травы (листья сенны, каскара, алоэ, кора крушины, корень ревеня). Эти средства способствуют усилению перистальтики, могут сопровождаться болями в животе, приводить к поносам с потерей жидкости и электролитов. Они должны применяться однократно, не часто, по строгим показаниям (подготовка к операции на толстой кишке, к колоноскопии, ирригоскопии).
5. Усиливающие моторную функцию кишечника (прокинетики). Предпочтение в этой группе отдается цизаприду (Координаксу). Данные препараты следует применять только по назначению врача.
В противоположность прежнему разделению слабительных препаратов по их преимущественному действию на тонкую или толстую кишку в настоящее время принято считать, что все слабительные средства, хотя и в разной степени, действуют на оба отдела кишечника.
Побочные эффекты слабительных средств.
Следует упомянуть об отрицательных сторонах действия слабительных. Их применение сопровождается повышением потери белка, калия через кишечник, снижением тонуса кишечной мускулатуры, привыканием рецепторного аппарата, требующего все больших доз слабительных средств, нередко запоры сменяются поносами из-за возникающего медикаментозного колита. При хроническом запоре следует избегать длительного ежедневного приема слабительных средств.
Различные препараты обладают и разным спектром побочных эффектов. Очень часто больной сталкивается с ситуацией, когда на фоне первоначального благоприятного действия при повышении дозы возникает привыкание, которое в дальнейшем ведет к злоупотреблению слабительными препаратами со всеми отрицательными последствиями. Во многих случаях приходится проводить кропотливую работу, направленную на отвыкание пациентов от приема слабительных, особенно тогда, когда к жалобам, связанным с задержкой стула, присоединяются жалобы, свойственные синдрому раздраженного кишечника (тянущие, иногда схваткообразные боли в животе, метеоризм и др.).
Запоры и геморрой
Хронические запоры и геморрой, является самым частым сочетанием, и сопутствующим геморрою состоянием. Невозможно подчас определить первичность геморроя и вторичность запоров и наоборот. Геморрой без запоров встречается редко, в то время как лица, страдающие хроническими запорами, почти все без исключения отмечают кровотечения при дефекации, боли, зуд в области заднего прохода и, при длительном анамнезе, выпадение геморроидальных узлов.
Если геморрой в определенном числе случаев может проявляться довольно рано, у молодых людей (обычно с наследственным семейным анамнезом), то запоры чаще всего развиваются позже, в связи с хроническим нарушением ритма питания и необходимого состава диеты.
Запоры во многом усугубляют развитие геморроя, ускоряют возникновение его клинических проявлений. Жалобы, характерные для геморроя, появляются у больных, как правило, после периода затрудненного стула, причем одна из главных жалоб - сами запоры. Таким образом, борьба с запорами на любом этапе проявления геморроя и даже до всяких его проявлений у лиц с выявленными при профилактических осмотрах признаками геморроя (бессимптомная стадия) есть важнейшая консервативная мера профилактики и лечения этого заболевания.
К сожалению, некоторые врачи, к которым, попадает больной геморроем, не обращают должного внимания на терапию запоров у данного контингента, что во многом сводит на нет усилия консервативной терапии и влияет отрицательно на исходы операций по поводу геморроя. При всех многочисленных средствах, предлагающихся для лечения геморроя; в том числе и при применении склерозирующих инъекций и оперативных вмешательств, рецидив болезни весьма вероятен, если у больного останутся или возникнут запоры. Так что лечить запоры у больных геморроем просто необходимо, независимо от их первопричины.
![]() 8 391 205 03 95
8 391 205 03 95![]() 8 391 205 10 21
8 391 205 10 21![]() пр. Мира, 5
пр. Мира, 5